In diesem Artikel befassen wir uns mit dem transformativen Potenzial der KI-Technologie für die Arzneimittelforschung. Nach einer Einführung in die Herausforderungen, mit denen die Pharmaindustrie konfrontiert ist, diskutieren wir drei verschiedene Aspekte, wie die KI-Technologie zur Lösung dieser Herausforderungen eingesetzt wird.
Beim ersten Thema handelt es sich um eine Übersicht einiger Partnerschaften zwischen dem Pharmasektor und Anbietern von KI-Lösungen. Hier geben wir einen Einblick, welcher Aspekt der Technologie die Grundlage für die Partnerschaft ist.
Der zweite Aspekt ist, wie Cloud-Lösungen und Cloud-Anbieter die Einführung der KI-Technologie erheblich erleichtert haben.
Schließlich beschreiben wir, wie einige Hindernisse, die einer vollständigen Übernahme von KI entgegenstehen, mit einem neuen KI-Paradigma namens “Erklärbare KI” überwunden werden.
Mehr Artikel zum Thema Health & Life Science finden Sie hier.
Einleitung
Ziel der Arzneimittelforschung ist es, neue Medikamente zu finden, die zur Vorbeugung oder Behandlung einer bestimmten Krankheit beitragen können. Obwohl es viele verschiedene Arten von Arzneimitteln gibt, handelt es sich bei vielen um kleine, chemisch synthetisierte Moleküle, die spezifisch an ein Zielmolekül binden können, in der Regel ein Protein, das an einer Krankheit beteiligt ist.
Bislang haben Forscher:innen große Molekülbibliotheken durchforstet, um Kandidaten zu finden, die als Arzneimittel in Frage kommen. Obwohl der rationale strukturbasierte Ansatz für die Entwicklung von Arzneimitteln im Laufe der Zeit immer mehr Verbreitung gefunden hat, erfordert dieser Ansatz auch heute noch mehrere Runden der Entwicklung, Synthese und Prüfung. Da es im Allgemeinen schwierig ist, vorherzusagen, welche chemische Struktur sowohl die gewünschten biologischen Wirkungen als auch die für ein wirksames Arzneimittel erforderlichen Eigenschaften aufweist, ist der Prozess der Arzneimittelentdeckung nach wie vor teuer und zeitaufwändig.
Auch wenn ein neuer Arzneimittelkandidat im Labor Potenzial zeigt, kann er in klinischen Versuchen scheitern. Tatsächlich schaffen es weniger als 10 % der Arzneimittelkandidaten nach Phase-I-Versuchen auf den Markt [1]. In Anbetracht dessen ist es nicht verwunderlich, dass Forscher:innen auf die beispiellose Datenverarbeitungsleistung der KI setzen, um die Entdeckung neuer Medikamente zu beschleunigen und ihre Kosten zu senken. KI-Technologien haben das Potenzial, die Entwicklung von Arzneimitteln zu beschleunigen, Innovationen voranzutreiben, die Effizienz klinischer Studien zu verbessern oder die Verabreichung von Medikamenten zu kontrollieren.
Drei Bereiche, in denen KI bereits ein leistungsfähiges Werkzeug ist, sind Target Identification, Target Deconvolution und De Novo Molecular Design. Bei der Target Identification erleichtert die KI die ganzheitliche Identifizierung neuer Targets, indem sie multidimensionale Datenquellen wie Omics, Text und Bilder oder öffentliche Datenbanken nutzbar macht. Alternativ dazu verbessert KI die Geschwindigkeit und Effizienz beim Durchsuchen von Bibliotheken bereits existierender Verbindungen nach Treffern, die als Wirkstoffe für neue Medikamente in Frage kommen (Target Deconvolution).
Beim De Novo Molecular Design kann die KI die chemischen Eigenschaften potenziell gründlicher und schneller analysieren und anpassen, als es Wissenschaftler:innenteams mit herkömmlichen Methoden können. Neben dem Design neuartiger chemischer Verbindungen ist die synthetische Machbarkeit, d. h. die Fähigkeit, die Verbindung zu synthetisieren, eine der Herausforderungen des KI-gestützten De-novo-Wirkstoffdesigns.

Außerdem sind Protein-Ligand-Wechselwirkungen Quantensysteme, d. h. Systeme, die auf der Quantenphysik basieren. Exakte Methoden zur Vorhersage dieser Systeme sind derzeit für Standardcomputer rechnerisch nicht zu bewältigen, während Näherungsmethoden oft nicht genau genug sind, wenn Wechselwirkungen auf atomarer Ebene entscheidend sind. Eine vollständige Simulation dieser Systeme wird vielleicht mit der zukünftigen Quantencomputertechnologie möglich sein.
Partnerschaften zwischen KI und Pharmaindustrie
In einer Ende 2021 durchgeführten Umfrage unter Fachleuten aus der Pharmaindustrie nannten 40 % der Befragten KI als die Technologie, die im Jahr 2022 den größten Einfluss auf die Branche haben wird. Ein ähnlicher Prozentsatz glaubt auch, dass Forschung und Entwicklung am meisten von der Digitalisierung im Pharmasektor profitieren würden. [2]
In den letzten Jahren haben Biopharmaunternehmen Strategien zur Integration von KI in den Entdeckungsprozess angenommen, wie z. B. die Einrichtung von Teams aus KI-Expert:innen und Datenanalyst:innen, Investitionen in Start-ups oder die Zusammenarbeit mit Tech-Giganten und/oder Forschungszentren. Expert:innen zufolge liegt die Hauptmotivation für diese Kooperationen entweder darin, Zugang zu wichtigen Daten zu erhalten oder darin, dass der KI-Partner ein nützliches und zugängliches digitales Produkt für eine KI-Lösung bereitstellt.

Führende Pharmaunternehmen, darunter Roche, Pfizer, Merck, AstraZeneca und andere, haben bereits vor einigen Jahren begonnen, mit Unternehmen aus dem Bereich der KI zusammenzuarbeiten. Ein Beispiel aus dem Jahr 2018: Das Massachusetts Institute of Technology (MIT) gründete mit Novartis und Pfizer das Pharmaceutical Discovery and Synthesis Consortium. Ziel dieses Konsortiums war es, die Hindernisse zwischen KI und Arzneimittelforschung zu beseitigen und die Aufmerksamkeit auf relevante Probleme in diesem Bereich zu lenken.
Heute gibt es zahlreiche Beispiele für Partnerschaften zwischen der Pharmaindustrie und großen Technologie- oder KI-Unternehmen. Dazu gehören Pfizer-IBM Watson, Novartis-Microsoft, Sanofi-Excentia und andere (Abbildung 1). Abgesehen von Partnerschaften sind bisher nur wenige Fusionen und Übernahmen zu verzeichnen. In einigen Fällen haben Pharmaunternehmen einen Teil des Unternehmens aufgekauft, um im Vorstand des KI-Unternehmens zu sitzen und dessen Richtung mitzubestimmen.
KI wird durch große Datenmengen angetrieben. Die wichtigste Fähigkeit der KI besteht darin, große Datenmengen zu verarbeiten und subtile und komplexe Muster zu erkennen. Bei chemischen Prozessen bietet die KI die Möglichkeit, einen größeren Raum von Strukturen und Wechselwirkungen zu durchsuchen. Dies ist die Grundlage für die Zusammenarbeit zwischen dem KI-Unternehmen Iktos und Pfizer bzw. Merck KGaA.
Chemische Daten und Daten aus dem Screening kleiner Moleküle sind nicht die einzige Art von Daten, zu denen die KI-Technologie einen wichtigen Beitrag leisten kann. Auch Datensätze, die für die Planung klinischer Studien entscheidend sind, profitieren von der KI.
Elektronische Gesundheitsakten, demographische Daten von Patient:innen, die Ergebnisse früherer klinischer Studien oder Informationen aus Omics-Bereichen sind allesamt Daten, die als Input für KI-Modelle zur Planung von Studien verwendet werden können. Dies ist zum Beispiel die Grundlage für die Zusammenarbeit von Janssen mit Unternehmen wie Komodo Health.
Vorhandene Daten können Einschränkungen in Bezug auf Quantität, Qualität oder Eignung für bestimmte Anwendungen aufweisen. Aus diesem Grund hat die Generierung von Daten speziell für KI-Anwendungen an Bedeutung gewonnen.
Mindestens zwei Unternehmen haben dieses Ziel als Grundlage: Insitro und Recursion. Letzteres verwendet Bilder von Millionen von Zellen, die mit genetischen und chemischen Störungen behandelt wurden, um die Beziehung zwischen den Störungen und den morphologischen Merkmalen der Zellen zu untersuchen. Bayer fand diesen Ansatz so vielversprechend, dass sie im Jahr 2020 eine Vereinbarung mit Recursion unterzeichneten, um an fibrotischen Erkrankungen zu arbeiten.

Arzneimittelforschung und die Cloud
In den letzten 25 Jahren war das virtuelle Screening von kleinen Molekülkandidaten die dominierende Technologie in der Arzneimittelforschung. Das virtuelle Screening ist die rechnerische Grundlage der computergestützten Arzneimittelentdeckung (Computer-Aided Drug Discovery, CADD) und das konzeptionelle Gerüst der High Throughput Screening Technologie.
Virtuelles Screening
Das Prinzip des virtuellen Screenings besteht darin, ein 3D-Modell des Zielortes zu erstellen und so viele kleine Moleküle wie möglich anzudocken, um abzuschätzen, wie gut sie binden könnten. Die Modellierung von 3D-Strukturen ist eine komplexe Aufgabe, die in der Regel für die Leistung der zu einem bestimmten Zeitpunkt verfügbaren Systeme optimiert wird. Das bedeutet, dass ein System, das vor nur 10 Jahren entwickelt wurde, auf einer Hardware, die nur 3 % der heutigen Leistung hat, genaue Ergebnisse liefern würde.
Das Geschäftsmodell für virtuelles Screening erfordert in der Regel den Kauf der leistungsstärksten Compute-Server und Grafiksysteme, die erschwinglich sind, sowie Lizenzen für eine breite Palette teurer Modellierungssoftware-Plattformen. Diese Anlagen werden von den Forscher:innen oft je nach Bedarf genutzt: mal werden sie mit voller Leistung eingesetzt, mal stehen sie still. Dies ist keine kosteneffiziente Lösung.
Cloud Computing
Das Cloud Computing hebt diese Beschränkungen auf. Cloud-Computing-Ressourcen werden auf Anfrage verkauft, in der Regel stundenweise, sind elastisch und werden vollständig vom Anbieter verwaltet. Dies bietet eine leistungsstarke Alternative zu den riesigen internen Ressourcen, die erforderlich wären, um das virtuelle Screening Realität werden zu lassen.
Da mit Cloud-Ressourcen die Rechenleistung keine Einschränkung mehr darstellt, können kompromissloses CADD und effektives virtuelles Screening entwickelt werden, ohne Kompromisse bei der Qualität und Strenge des Modellierungswerkzeugs eingehen zu müssen.
Heute nutzen mehrere Pharmaunternehmen bekannte Cloud-Anbieter, um ihre Forschungsprogramme voranzutreiben. AWS ist ein wichtiges Element in den Forschungs-, Entwicklungs- und Produktionsprozessen von Moderna. Die mRNA-Plattform von Moderna nutzt die Rechenkapazität von AWS, um eine Vielzahl von Algorithmen auszuführen, die individuelle mRNA-Moleküle entwerfen. Mit AWS ist das Unternehmen in der Lage, die Zeit zu verkürzen, die benötigt wird, um neue Moleküle auf den Markt zu bringen – etwas, das vor einigen Jahren noch unmöglich war.
Kombination von Cloud und KI
Alphabet hat auch die Cloud mit KI kombiniert, um die Forschung in den Biowissenschaften zu beschleunigen. Im Jahr 2014 erwarb das Unternehmen das in London ansässige Unternehmen DeepMind. Vier Jahre später nahm DeepMinds AlphaFold an einem Wettbewerb zur Proteinfaltung teil, bei dem es 97 andere Teilnehmer bei der genauen Vorhersage von Proteinstrukturen schlug und diese schwierige Aufgabe zum ersten Mal löste.
Neben Alphabets Arbeit an Proteinstrukturen haben sie kürzlich ein neues Unternehmen, Isomorphic Laboratories, gegründet, das verspricht, die Arzneimittelforschung zu revolutionieren, indem es die von den Schwesterunternehmen DeepMind und AlphaFold entwickelte Technologie nutzt.
Explainable AI / Erklärbare KI
Viele Unternehmen wollen KI einsetzen, fühlen sich aber aufgrund von mangelndem Vertrauen noch nicht damit wohl, dem KI-Modell wirkungsvollere Entscheidungen zu überlassen. Dazu müssen Stakeholder nachvollziehen können, wie die KI zu einem bestimmten Ergebnis gekommen ist, und sich von der Qualität des Resultats aus der Sicht von Expert:innen überzeugen können. Deshalb ist die “Erklärbarkeit” von KI so wichtig.
Vertrauen in KI aufbauen
Wie kann man Vertrauen in KI-Modelle aufbauen? Wir zeigen, wie das Modell funktioniert. Insbesondere beschreiben wir die Gesamtstruktur des Modells, quantifizieren aber auch, wie viel die verschiedenen Merkmale zu einer bestimmten Vorhersage beitragen. Diese Methoden sind typisch für eine neue Art von KI-Methodik, die als Explainable AI (XAI) bezeichnet wird.
Im Hinblick auf die Bewertung einer spezifischen Vorhersage sind zwei algorithmische Lösungen zu nennen. Dabei handelt es sich um Local Interpretable Model-agnostic Explanations (LIME) und SHapley Additive ExPlanations (SHAP) [3]. Beide Algorithmen liefern eine Post-hoc-Erklärung der Systemlogik, mit der sich die Leistung selbst von Black-Box-KI-Systemen bewerten lässt, bei denen die inneren Abläufe nicht bekannt sind.
XAI wird sowohl im öffentlichen als auch im privaten Bereich aktiv erforscht. Große Cloud-Anbieter wie GCP und IBM haben XAI-Tools in ihre Plattformen integriert [4 & 5]. Eine Gruppe von Forscher:innen an der TU Berlin entwickelt aktuell eine Sammlung von Metriken für XAI mit dem Namen QUANTUS [6]. Alternativ dazu hat die US DARPA ein “Explainable AI”-Programm [7] ins Leben gerufen, das darauf abzielt, “Glaskasten”-Modelle zu erstellen, welche für einen “Menschen in der Schleife” erklärbar sind.
Einschränkungen von XAI
Eine der Einschränkungen beim Einsatz von XAI in der Arzneimittelforschung ist die chemische Sprache, die zur Darstellung des Entscheidungsraums des Modells verwendet wird. Bei der Entwicklung von “Low-Level”-Moleküldarstellungen von Verbindungen, die sowohl für KI geeignet als auch für Chemiker:innen verständlich sind, wurden erhebliche Fortschritte erzielt. Diese Darstellungen beruhen in der Regel auf String-Darstellungen von Molekülen. Ein bekanntes Beispiel dafür ist das Simplified Molecular Input Line Entry System (SMILES) [8].
Der XAI fehlt derzeit für die Arzneimittelforschung eine offene Plattform, auf der Forscher:innen synergetisch arbeiten und Software und Werkzeuge für die Modellinterpretation gemeinsam nutzen können. EU-Projekte wie MELLODDY [9] zur gemeinsamen Nutzung von Daten und zur kollaborativen Modellentwicklung ohne Preisgabe geschützter Informationen stellen hierbei einen wichtigen ersten Schritt dar.

Fazit
Der Gesundheitssektor steht derzeit vor mehreren komplexen Herausforderungen, wie zum Beispiel dem Kostenanstieg für Medikamente und Therapien, welche tiefgreifende Veränderungen in diesem Bereich erfordern. Die KI kann einen wichtigen Beitrag leisten, der über die Beschleunigung der Markteinführung neuer Produkte hinausgeht. Dazu könnte beispielsweise die Verwendung und Reaktion von Patient:innen auf ein bestimmtes Medikament gehören.
Zu weiteren Beiträgen der KI für den Pharmasektor können die Entwicklung von Arzneimitteln in der richtigen Darreichungsform und die Unterstützung einer schnellen Entscheidungsfindung bei der Arzneimittelherstellung, die zu einer besseren Produktqualität und einer Konsistenz von Charge zu Charge führen könnte gezählt werden. Auch ist die Unterstützung bei der Planung und Rekrutierung von Patient:innen für klinische Studien oder ein Beitrag zur Sicherheit und Wirksamkeit des Produkts während der klinischen Studien möglich (Abbildung 2).
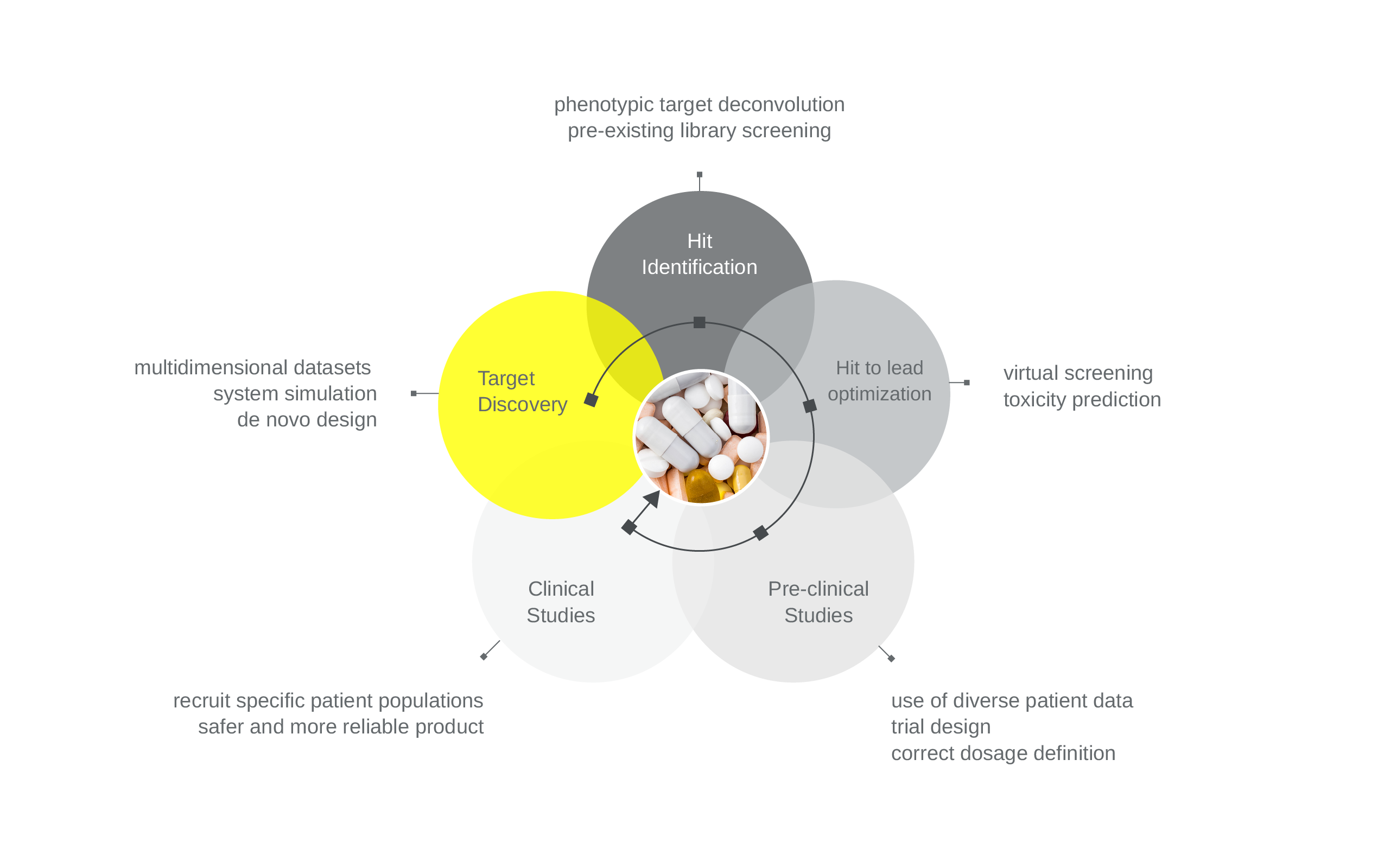
Der gesamte Erfolg der KI hängt von der Verfügbarkeit einer beträchtlichen Datenmenge ab. Zu den weiteren Herausforderungen, die eine umfassende Einführung von KI in der Pharmaindustrie verhindern könnten, gehören der Mangel an qualifiziertem Personal für den Betrieb von KI-basierten Plattformen, begrenzte Budgets für kleine Organisationen, Befürchtungen über den Verlust von Arbeitsplätzen und Skepsis gegenüber den von der KI gezogenen Schlussfolgerungen.
Obwohl noch keine Medikamente auf dem Markt sind, die mit KI-basierten Ansätzen entwickelt wurden, deutet ein prognostiziertes Wachstum von 30 % zwischen 2017 und 2025 darauf hin, dass KI den pharmazeutischen und medizinischen Sektor in naher Zukunft wahrscheinlich revolutionieren wird.
Referenzen:
[1] “Clinical Development Success Rates 2006-2015 – Biotechnology ….”
[2] GlobalData Healthcare, “AI will trend as the most disruptive technology in the pharmaceutical sector in 2022”,
2022
[3] SHAP, “Welcome to the SHAP documentation”, 2018
[4] Google Cloud Platform, “Explainable AI SDK”, n.d.
[5] IBM Research Trusted AI, “AI Explainability 360”, n.d.
[6] UMILAB, “Understandable Machine Intelligence Lab”, n.d.
[7] Darpa, “Explainable Artificial Intelligence (XAI)”, 2018
[8] Daylight Chemical Information Systems, “SMILES – Daylight Theory”, n.d.
[9] https://www.melloddy.eu/



